
Isabelle Aubert, chercheuse principale à l’Institut de recherche Sunnybrook, et sa doctorante, Kristiana Xhima, ont dirigé la première étude utilisant des ultrasons focalisés pour délivrer une molécule au cerveau afin de relancer la fonction des neurones vitaux pour l’apprentissage et la mémoire chez les souris atteintes de la maladie d’Alzheimer.
Une percée qui vise à restaurer la fonction des neurones vitaux pour l’apprentissage et la mémoire
Alors que des milliards de dollars ont été investis dans la recherche d’un remède pour la maladie d’Alzheimer, les progrès ont été d’une lenteur frustrante. Les traitements approuvés pour cette maladie réduisent les symptômes, mais rien ne peut arrêter son évolution destructrice.
Dans ce contexte, les neuroscientifiques du Sunnybrook Research Institute (SRI) développent des stratégies pour contrer la dégénérescence du cerveau dans la maladie d’Alzheimer. Une approche, menée par le Dr Isabelle Aubert, scientifique senior du SRI, et sa doctorante, Kristiana Xhima, s’avère prometteuse. Elles ont réalisé la première étude préclinique utilisant des ultrasons focalisés pour délivrer un composé qui sauve la fonction des cellules du cerveau qui sont altérées dans la maladie d’Alzheimer.

Les chercheurs ont ciblé un récepteur sur ces neurones, ce qui a provoqué la libération d’un messager chimique par les neurones, signe d’une fonction restaurée. Cette étude fondamentale a été publiée dans Science Advances le 22 janvier, 2020.
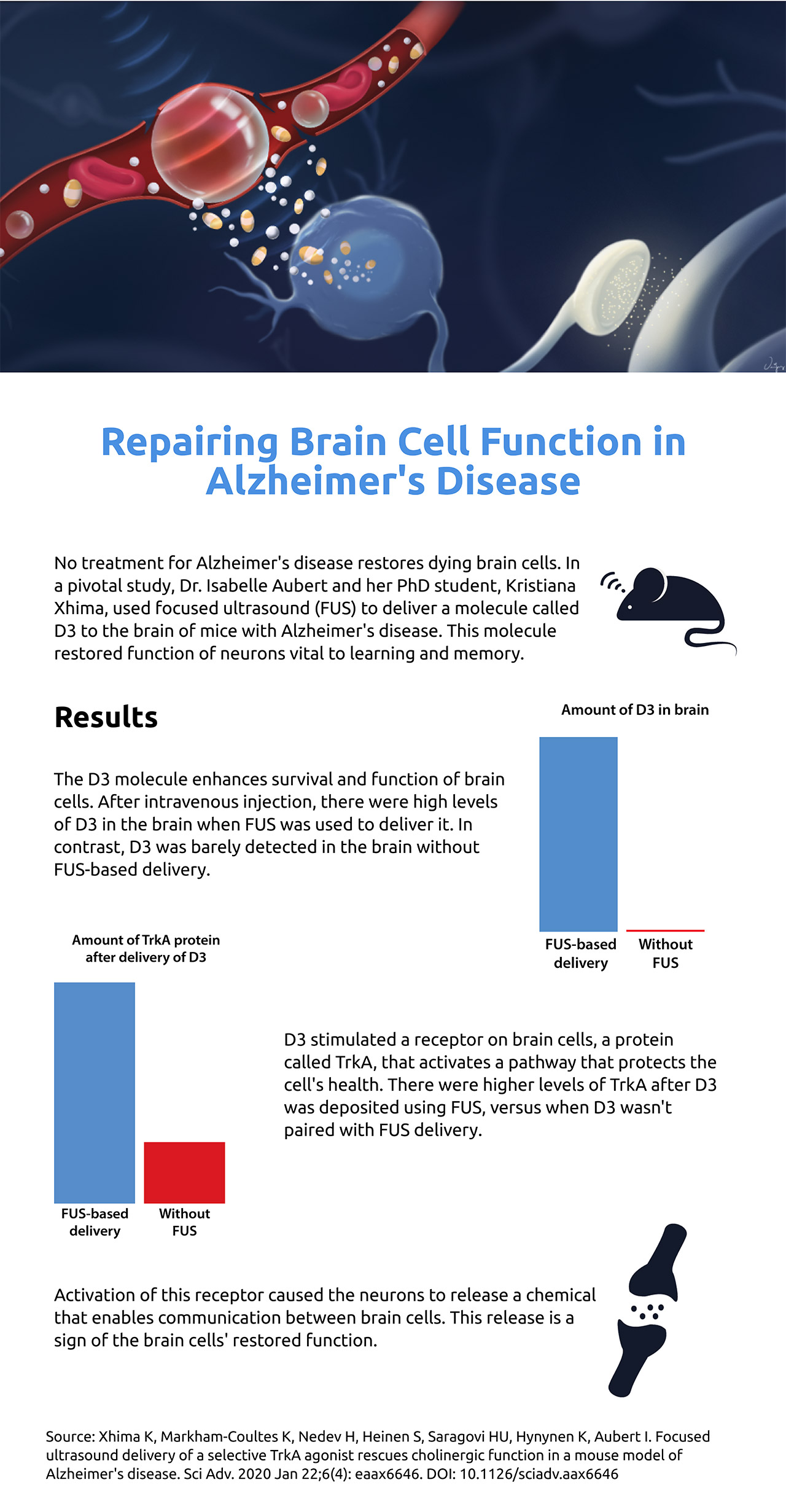
Leur méthode rétablit la communication entre les neurones cholinergiques, des cellules cérébrales essentielles à l’apprentissage et à la mémoire. Cette communication est court-circuitée dans la maladie d’Alzheimer, ce qui a un effet dévastateur. Dans un cerveau sain, les neurones se connectent au niveau des synapses, où des messagers chimiques appelés neurotransmetteurs transportent l’information d’une cellule à l’autre. Par exemple, les neurones cholinergiques transmettent l’acétylcholine. La maladie d’Alzheimer entrave cette transmission vitale. On pense que les protéines toxiques qui s’accumulent dans le cerveau, amyloïde et tau, entraînent la perte de neurones ; à mesure que les cellules du cerveau meurent, il y a moins de neurotransmetteurs, comme l’acétylcholine, pour transporter les messages entre les cellules.
Aubert et Xhima ont utilisé des ultrasons focalisés pour délivrer de manière non invasive une molécule appelée D3 à travers la barrière hémato-encéphalique, là où se trouvent précisément les neurones cholinergiques, dans le cerveau de souris atteintes de la maladie d’Alzheimer. Ils ont travaillé avec le Dr Kullervo Hynynen, un pionnier des ultrasons focalisés qui a été le premier à montrer que cette technologie pouvait ouvrir localement et temporairement la barrière hémato-encéphalique sous l’effet de l’IRM. La molécule imite une protéine appelée facteur de croissance des nerfs (NGF), qui est fabriquée dans le cerveau et qui est importante pour la santé des neurones cholinergiques. Au début de la maladie d’Alzheimer, on observe des changements dans la façon dont ces neurones accèdent au NGF et l’utilisent.
En essayant de ranimer les neurones malades, les chercheurs ont déjà administré des thérapies à base de NGF au cerveau, mais ils ont rencontré des obstacles. L’un d’eux est la barrière hémato-encéphalique, qui protège le cerveau contre les toxines en circulation, mais qui bloque également les médicaments et autres thérapies. C’est pourquoi le NGF a été administré par des trous pratiqués dans le crâne, associés à des dispositifs qui pénètrent dans les tissus cérébraux – une procédure risquée, en particulier pour les patients fragiles.
En revanche, les ultrasons focalisés sont non invasifs. Il utilise des microbulles et un agent de contraste pour l’IRM qui sont perfusés par voie intraveineuse. Lorsque les bulles atteignent la zone cible, telle que visualisée par l’IRM – dans ce cas, le cerveau antérieur basal, où se trouvent les neurones cholinergiques – une énergie acoustique est appliquée, ce qui fait que les bulles bousculent les jonctions serrées entre les cellules qui constituent la barrière hémato-encéphalique, la rendant ainsi plus perméable.
Une distinction essentielle entre D3 et le NGF est que D3 se lie uniquement à un récepteur appelé TrkA (prononcé « Track A »), qui active une voie neuroprotectrice, et non p75, un récepteur qui peut causer la mort des cellules et l’inflammation. En revanche, le NGF se lie aux deux récepteurs. La molécule D3 a été développée par le Dr Uri Saragovi à l’Institut Lady Davis, Hôpital général juif, Université McGill.
« Le Dr Saragovi a publié plusieurs articles sur la D3 montrant qu’elle se lie uniquement au TrkA, mais il a dû procéder à des injections intracrâniennes invasives pour l’amener dans le cerveau. Quand il a entendu parler des ultrasons focalisés, il s’est dit : « Wow, c’est merveilleux. Pouvez-vous l’administrer ? Nous savions qu’il était sans danger par voie intraveineuse et qu’il serait encore meilleur lorsqu’il atteindrait le cerveau. C’était l’une de ces situations où nos connaissances de base sur cette molécule particulière nous permettaient déjà de nous sentir en bonne forme », explique Aubert.
L’utilisation d’ultrasons focalisés pour administrer la D3 est non seulement plus sûre, mais aussi plus précise, note M. Xhima. « Les méthodes d’administration du NGF ont été réalisées par des injections [cérébrales]. Le traitement [doit être] administré à de très petites structures dans les profondeurs du cerveau. Avec cette chirurgie, il est difficile de confirmer si le ciblage est précis, alors qu’avec l’échographie focalisée guidée par IRM, nous pouvons injecter un agent de contraste IRM et voir où la barrière hémato-encéphalique s’ouvre pour administrer le traitement avec plus de précision », dit-elle.
Après le traitement, ils ont vu un signe de succès: « Nous avons mis au point une stratégie de sonication pour nous assurer que nous sommes capables d’ouvrir la barrière hémato-encéphalique et de ne pas causer de dommages. Ensuite, nous avons examiné les voies de signalisation. Nous avons constaté que le TrkA est activé et que les neurones tirent et libèrent de l’acétylcholine », explique Xhima. L’étape suivante consiste à déterminer si le composé améliore la mémoire, ce que les chercheurs étudient.
Pour Aubert, les résultats obtenus avec la molécule D3 représentent une avancée passionnante. Elle note que les essais cliniques testant des médicaments qui éliminent l’amyloïde et le tau ont été décevants, mais la combinaison de la D3 avec un tel traitement pourrait être un coup de poing efficace. « Rien n’a vraiment réussi à être curatif, jusqu’à présent. La maladie d’Alzheimer est si complexe. Bien sûr, nous devons nous débarrasser de la pathologie – les plaques et les enchevêtrements – mais nous devons aider le cerveau à mieux fonctionner. C’est là que les composants neurofonctionnels entrent en jeu ».
Source du texte:
Sunnybrook Research Institute https://sunnybrook.ca/research/media/item.asp?i=2039&f=focused-ultrasound-first
Traduction: CAN-ACN
Apprenez-en plus ici (en anglais seulement):
Behind the research: Study looks at fighting Alzheimer’s disease in a new way
